Décryptage beauté atomique : la charge nucléaire effective
Imaginez un atome, véritable écrin de minuscules particules. Au centre, le noyau, un cœur vibrant chargé positivement. Autour, les électrons, graciles danseurs négatifs, virevoltant sur différentes orbites. Mais que se passe-t-il réellement au cœur de cette danse subatomique ? La réponse se trouve dans la charge nucléaire effective, un concept essentiel pour décrypter les secrets de la chimie et comprendre l'interaction des éléments.
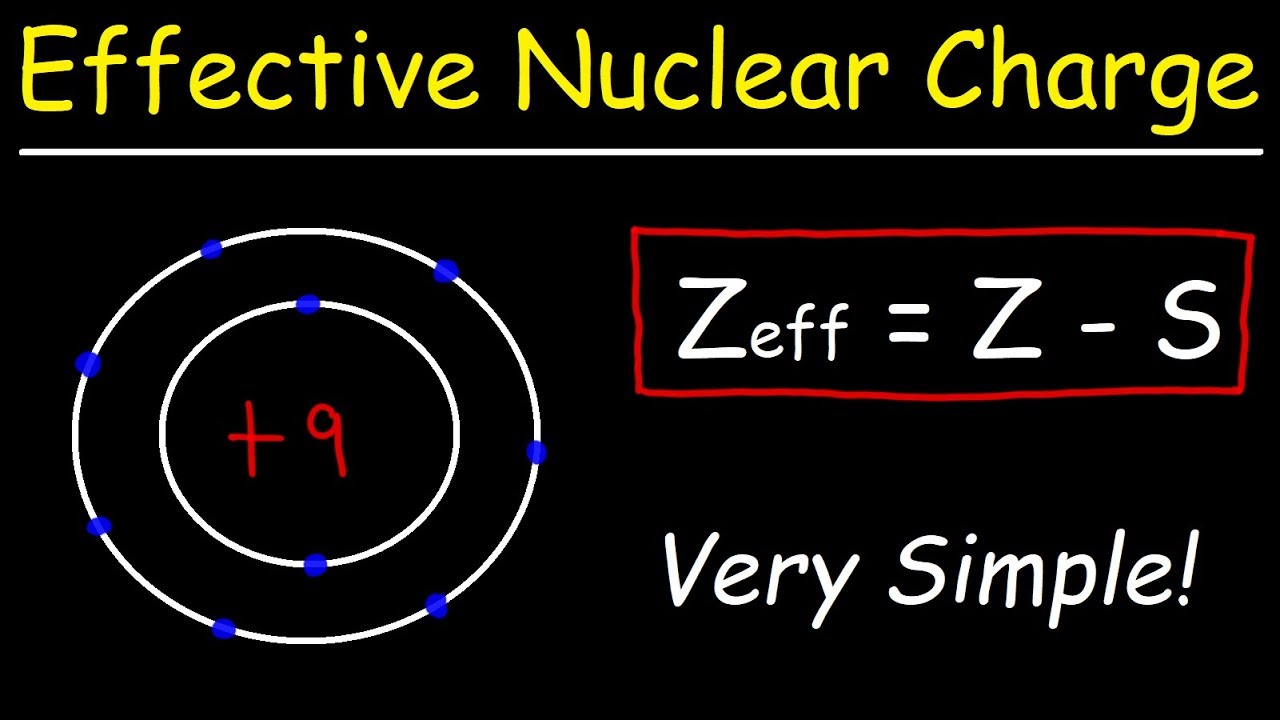
La charge nucléaire effective, c'est l'attraction réelle qu'un électron ressent de la part du noyau. En effet, les électrons les plus proches du noyau, comme un bouclier protecteur, atténuent l'attraction du noyau sur les électrons plus externes. Imaginez un aimant puissant attirant des billes métalliques : si vous placez d'autres billes entre l'aimant et la dernière bille, l'attraction sera moins forte. C'est le même principe pour les électrons et le noyau.
Ce concept, introduit par John Slater dans les années 1930, est crucial pour comprendre les propriétés chimiques des éléments. Il permet d'expliquer pourquoi certains atomes sont plus réactifs que d'autres, pourquoi certains forment facilement des liaisons et d'autres non. La charge nucléaire effective est la clé pour décrypter le comportement des éléments, véritable alphabet de la matière.
Comprendre la charge nucléaire effective, c'est comme décoder le langage secret des atomes. Elle influence la taille des atomes, leur énergie d'ionisation (l'énergie nécessaire pour arracher un électron) et leur affinité électronique (l'énergie libérée lorsqu'un atome capture un électron). Ces propriétés déterminent comment les atomes interagissent entre eux, formant des molécules et créant la diversité du monde qui nous entoure.
Un des principaux défis liés à la charge nucléaire effective est sa complexité de calcul. Bien que le concept soit simple à saisir intuitivement, le calcul précis de cette charge nécessite des modèles mathématiques sophistiqués. Cependant, la compréhension de ce concept, même de manière simplifiée, ouvre la porte à une meilleure compréhension du monde microscopique et de ses implications macroscopiques.
Prenons l'exemple du sodium (Na) et du chlore (Cl). Le sodium a une charge nucléaire effective plus faible sur son électron externe que le chlore. Cela signifie que l'électron externe du sodium est moins fortement attiré par son noyau et peut donc être plus facilement arraché. C'est pourquoi le sodium est très réactif et forme facilement des liaisons avec d'autres atomes, comme le chlore, qui a une forte affinité pour les électrons.
FAQ :
1. Qu'est-ce que la charge nucléaire effective ? Réponse : C'est l'attraction réelle ressentie par un électron de valence.
2. Pourquoi est-elle importante ? Réponse : Elle détermine les propriétés chimiques des éléments.
3. Comment la calculer ? Réponse : Des modèles mathématiques complexes sont utilisés.
4. Quel est le rôle des électrons internes ? Réponse : Ils font écran et réduisent l'attraction du noyau.
5. Comment influence-t-elle la réactivité ? Réponse : Une faible charge nucléaire effective augmente la réactivité.
6. Quel est le lien avec l'énergie d'ionisation ? Réponse : Une faible charge effective facilite l'ionisation.
7. Quel est le lien avec la taille de l'atome? Réponse: Une faible charge effective implique un rayon atomique plus grand.
8. Comment la charge nucléaire effective affecte-t-elle les liaisons chimiques? Réponse: Elle influence la capacité d'un atome à gagner ou perdre des électrons, déterminant ainsi le type de liaison chimique formée.
En conclusion, la charge nucléaire effective, bien que cachée au cœur de l'atome, est une force puissante qui façonne le monde qui nous entoure. Comprendre ce concept fondamental, c'est saisir l'essence même des interactions chimiques et décrypter les propriétés des éléments. De la réactivité du sodium à la stabilité du chlore, la charge nucléaire effective orchestre la danse subatomique qui donne naissance à la complexité et à la beauté de la matière. En explorant les mystères de l'infiniment petit, nous découvrons les clés pour comprendre l'infiniment grand.

1215 Periodic Trends in Atomic Properties | Kennecott Land

what is meant by effective nuclear charge | Kennecott Land

Effective Nuclear Charge Equation | Kennecott Land

what is meant by effective nuclear charge | Kennecott Land

what is meant by effective nuclear charge | Kennecott Land
Which Of The Following Have Higher Zeff Than Fluorine The 21 Correct | Kennecott Land

what is meant by effective nuclear charge | Kennecott Land

ANSWERED The effective nuclear charge of an atom i | Kennecott Land

11 Captivating Facts About Effective Nuclear Charge | Kennecott Land

Effective Nuclear Charge Definition Examples Trend Formula | Kennecott Land

Solved Chapter 5 Short Answer Item 20 e previo Item 20 Part | Kennecott Land

Calculate the effective nuclear charge a 3d | Kennecott Land

What is Effective Nuclear Charge | Kennecott Land

what is meant by effective nuclear charge | Kennecott Land
Question 4 of 23 Calculate the effective nuclear charge on a valence | Kennecott Land