De fascinerende wereld van atoomstraal trends in het d-blok
Waarom zijn sommige atomen groter dan andere? Deze ogenschijnlijk simpele vraag leidt ons naar de fascinerende wereld van atoomstralen en hun trends in het periodiek systeem. In het bijzonder het d-blok, de thuisbasis van overgangsmetalen, vertoont unieke en soms onverwachte trends in atoomgrootte. Dit artikel duikt diep in de complexiteit van de atoomstraal trend in het d-blok, van de fundamentele principes tot de praktische implicaties.
De atoomstraal, een maat voor de grootte van een atoom, speelt een cruciale rol in de chemische eigenschappen van elementen. In het d-blok, waar elektronen worden toegevoegd aan de d-orbitalen, zien we een subtiele maar belangrijke invloed op de atoomstraal. De effectieve kernlading, de aantrekkingskracht die de kern uitoefent op de elektronen, en de afscherming door binnenste elektronen spelen een sleutelrol in het bepalen van deze trend.
Historisch gezien was het begrijpen van de atoomstraal trend in het d-blok essentieel voor de ontwikkeling van de moderne chemie. Het heeft bijgedragen aan onze kennis van chemische binding, reactiviteit en de eigenschappen van materialen. Van de katalytische activiteit van overgangsmetalen tot de magnetische eigenschappen van bepaalde elementen, de atoomstraal speelt een belangrijke rol.
Een van de belangrijkste problemen met betrekking tot de atoomstraal trend in het d-blok is de complexiteit van de interacties tussen elektronen. De toenemende kernlading over een periode wordt gedeeltelijk gecompenseerd door de afscherming van de d-elektronen. Dit resulteert in een minder uitgesproken afname van de atoomstraal in vergelijking met de s- en p-blokken.
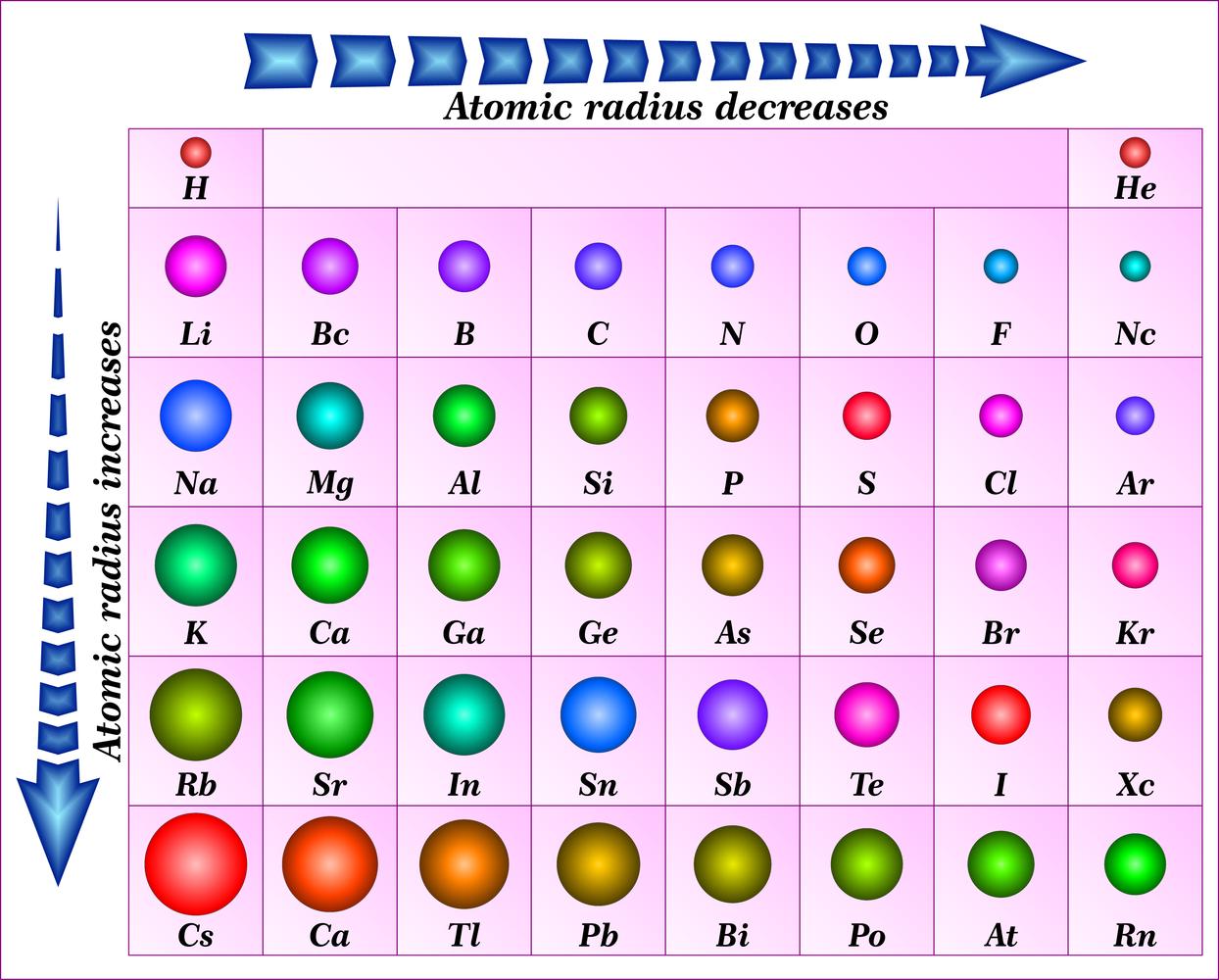
De atoomstraal wordt vaak gedefinieerd als de helft van de afstand tussen de kernen van twee identieke atomen die aan elkaar gebonden zijn. In het d-blok neemt de atoomstraal over het algemeen af van links naar rechts binnen een periode, maar deze trend is minder uitgesproken dan in andere blokken. Dit komt door de toenemende afscherming door de d-elektronen. Binnen een groep neemt de atoomstraal over het algemeen toe van boven naar beneden, zoals verwacht door de toevoeging van nieuwe elektronenschillen.
Verschillende factoren beïnvloeden de atoomstraal trend in het d-blok. Ten eerste neemt de kernlading toe van links naar rechts, wat leidt tot een sterkere aantrekking van de elektronen en een kleinere atoomstraal. Ten tweede zorgt de afscherming door de binnenste elektronen ervoor dat de effectieve kernlading die de buitenste elektronen ervaren, minder sterk toeneemt. Ten derde speelt de elektron-elektron repulsie binnen eenzelfde schil ook een rol.
Voor- en nadelen van inzicht in de Atoomstraal Trend in het d-blok
Inzicht in de atoomstraal trend in het d-blok biedt verschillende voordelen:
- Voorspellen van chemische reactiviteit
- Begrijpen van de eigenschappen van materialen
- Ontwerpen van nieuwe materialen met specifieke eigenschappen
Veelgestelde vragen over Atoomstraal Trend in het d-blok:
- Waarom is de trend minder uitgesproken in het d-blok? (Antwoord: Door de afscherming van de d-elektronen)
- Wat is de invloed van de effectieve kernlading? (Antwoord: Hogere effectieve kernlading leidt tot kleinere atoomstraal)
- Hoe beïnvloedt de atoomstraal de chemische reactiviteit? (Antwoord: Kleinere atomen zijn over het algemeen reactiever)
- Wat zijn de belangrijkste factoren die de atoomstraal beïnvloeden? (Antwoord: Kernlading, afscherming en elektron-elektron repulsie)
- Hoe wordt de atoomstraal gemeten? (Antwoord: Verschillende methoden, zoals röntgendiffractie)
- Waarom is kennis van deze trend belangrijk? (Antwoord: Voor het begrijpen en voorspellen van chemische eigenschappen)
- Zijn er uitzonderingen op de trend? (Antwoord: Ja, door specifieke elektronenconfiguraties)
- Hoe relateert de atoomstraal aan andere periodieke trends? (Antwoord: Correlatie met ionisatie-energie en elektronegativiteit)
Tips en trucs: Gebruik visualisaties van het periodiek systeem om de trend beter te begrijpen. Bestudeer de elektronenconfiguraties van de elementen in het d-blok.
De atoomstraal trend in het d-blok is een complex maar fascinerend aspect van de chemie. Begrijpen van deze trend is cruciaal voor het voorspellen van de chemische en fysische eigenschappen van overgangsmetalen en het ontwerpen van nieuwe materialen. Door de subtiele interacties tussen kernlading, afscherming en elektron-elektron repulsie te bestuderen, kunnen we dieper inzicht krijgen in de fundamentele principes die de chemie van het d-blok beheersen. Verdere studie van dit onderwerp is essentieel voor iedereen die geïnteresseerd is in de wonderen van de chemie en de toepassingen ervan in de moderne wereld. De kennis van atoomstralen en hun trends in het d-blok opent de deur naar een beter begrip van de eigenschappen van materialen en de ontwikkeling van nieuwe technologieën.

75 Atomic Properties and Periodic Trends | Kennecott Land

D Block Elements IIT JEE Study Material with Properties and Examples | Kennecott Land

All Periodic Trends in Periodic Table Explained with Image 2022 | Kennecott Land

Transition Elements Metallic Nature Atomic Radii | Kennecott Land

Periodic Table Trends Atomic Radius | Kennecott Land

Atomic Radius Periodic Table Trend | Kennecott Land

82 Atomic and Ionic Radius | Kennecott Land

Atomic Size Trend Diagram | Kennecott Land
.png)
Smallest Atomic Radius On Periodic Table at Juan McNair blog | Kennecott Land

Atomic Radius Trend Chart | Kennecott Land

Which arrangement is in the correct order of radius size a Mn Mn2 | Kennecott Land

99 Periodic Trends Atomic Size Ionization Energy and Metallic | Kennecott Land

Periodic Table Electronegativity Trend | Kennecott Land

atomic size trend in d block | Kennecott Land
atomic size trend in d block | Kennecott Land